Г. Г. Кривобородов1, К. А. Захаров 2, В. Б. Василюк2, Г. Г. Родионов3, М. В. Ветрова4
1Кафедра урологии и андрологии Российского национального исследовательского медицинского университета им. Н. И. Пирогова, Москва, Россия;
2ООО «Научно-исследовательский центр “Экобезопасность”», Санкт-Петербург, Россия;
3ФГБУ «Всероссийский центр экстренной и радиационной медицины им. А. М. Никифорова» МЧС России,
Санкт-Петербург, Россия;
4ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет
им. академика И. П. Павлова» Министерства здравоохранения Российской Федерации, Санкт-Петербург, Россия
Цель: в целях оценки биоэквивалентности и преимуществ новой лекарственной формы ингибитора
фосфодиэстеразы 5-го типа, силденафила, проведено два открытых исследования на здоровых
добровольцах-мужчинах.
Материалы и методы. В открытом рандомизированном перекрестном исследовании проведено
сравнение фармакокинетики после однократного приема силденафила в дозировке 50 мг натощак в
новой форме спрея (тестируемый препарат) и в традиционной таблетированной форме (препарат
сравнения) на 44 добровольцах (от 18 до 43 лет). Для оценки влияния приема пищи на фармакокинетику
проведено открытое нерандомизированное исследование на 6 здоровых добровольцах-мужчинах (от
23 до 35 лет), которые поэтапно получали силденафил (50 мг) после приема пищи: 1) спрей под язык
не запивая, 2) спрей в рот запивая и 3) таблетированная форма запивая. Для фармакокинетического
анализа проведен забор крови в течение 24 ч. Концентрация силденафила в плазме крови определялась
методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим
детектированием (ВЭЖХ/МС/МС). Основные параметры оценки: скорость (максимальное измеренное
значение концентрации; Cmax) и степень абсорбции (площадь под фармакокинетической кривой
«концентрация–время» за период наблюдения; AUC0–t) после однократного приема препаратов.
Дополнительно оценивались фармакокинетические профили биодоступности силденафила и его
активного метаболита, N-десметилсилденафила, а также безопасность препаратов.
Результаты. При сравнении препаратов натощак 90% доверительных интервалов (ДИ) отношений
средних значений Cmax и AUC0–t силденафила составили 82–106 и 82–101% соответственно. Выявлено
более раннее достижение максимальной концентрации силденафила при приеме тестируемого
препарата по сравнению с референтным препаратом (51 и 62 мин соответственно, Z-value=-2,25,
p-значение=0,0244). Кроме того, показано, что при приеме Виагры после приема пищи определение
силденафила в плазме отсрочено (через 30 мин) по сравнению с тестируемыми препаратами (через
10 мин), однако статистически значимых различий по показателю T max между препаратами не
выявлено. В двух исследованиях большинство нежелательных явлений были легкой или средней
степени тяжести и разрешались без последствий.
Обсуждение и выводы. Доказана биоэквивалентность новой лекарственной формы, спрея силденафила,
с традиционной формой по показателям биодоступности и выявлены преимущества альтернативной
формы по показателю скорости эффекта. Например, при приеме спрея показано более раннее
достижение максимальной концентрации силденафила и более раннее его определение в плазме
по сравнению с традиционной таблетированной формой. Результаты показывают, что новая
лекарственная форма силденафила – надежная альтернативная терапевтическая опция для
лечения эректильной дисфункции.
Введение. В настоящее время пероральные препараты группы ингибиторов фосфодиэстеразы 5-го типа (ФДЭ-5) служат терапией первой линии лечения эректильной дисфункции [1]. В России доступны четыре препарата: силденафила цитрат, тадалафил, варденафил и уденафил [2]. Силденафил относится к препаратам с самым быстрым началом действия. Он с успехом применяется в дозировке от 25 до 100 мг пациентами с эректильной дисфункцией вне зависимости от ее этиологии и длительности существования [3], в том числе пациентами с сопутствующей соматической патологией [4, 5]. Препарат отвечает основным требованиям, предъявляемым к препаратам перорального лечения: простой и незаметный прием в течение сравнительно короткого промежутка времени до сексуальной активности, высокая эффективность, хорошая переносимость, высокая селективность фармакологического действия, отсутствие влияния на ЦНС, быстрое всасывание и короткий период полураспада, обеспечивающий необходимую продолжительность действия [2].
С недавнего времени стали доступными альтернативные лекарственные формы ингибиторов ФДЭ-5, обладающие рядом преимуществ: не требуют проглатывания таблеток, обеспечивая удобство применения, позволяют избегать появления неприятных ощущений, возникающих при проглатывании [6]. В 2019 г. в России был зарегистрирован силденафил в новой лекарственной форме в виде спрея [12]. С целью оценки фармакокинетики силденафила в форме спрея при приеме натощак и после приема пищи проведено два открытых исследования.
Материалы и методы. Препараты. Действующим веществом тестируемого (T) и референтного (R) препаратов является силденафил. Тестируемый препарат в лекарственной форме «спрей для приема внутрь дозированный (12,5 мг/доза)» представляет собой водно-спиртовой раствор силденафила. В связи с тем что в рамках изучения биодоступности различные лекарственные формы для приема внутрь с немедленным высвобождением признаются одной и той же лекарственной формой [7], в качестве референтного препарата использованы таблетки силденафила. Препараты принимали в дозе 50 мг, что обеспечивало минимальный риск возникновения побочных явлений и надежное определение концентрации действующего вещества.
Участники и дизайн исследований. Участниками исследования были взрослые мужчины с верифицированным диагнозом «здоров». Для определения наличия критериев включения и невключения в рамках скрининга проводился сбор демографических и антропометрических данных, сбор анамнеза, физикальный осмотр, инструментальные и лабораторные методы диагностики, включая клинический и биохимический анализы крови, общий анализ мочи, ЭКГ, тестирование для определения употребления психоактивных веществ (анализ мочи на психотропные и наркотические вещества, психоактивные лекарственные препараты и тест на наличие алкоголя в выдыхаемом воздухе). Все критерии включения и невключения для двух исследований перечислены в Приложении 1. Первое исследование было открытым рандомизированным (1:1) сбалансированным по количеству участников, перекрестным в двух последовательных периодах с однократным приемом внутрь натощак силденафила (спрей и таблетки) на 44 взрослых здоровых добровольцах. Опираясь на данные ранее проведенных исследований силденафила в таблетированной форме в дозировке 100 мг [8, 9], представлялось целесообразным включить в исследование 44 мужчины.
Исследование состояло из периода скрининга, двух периодов приема препаратов (период наблюдения составлял 34 ч) и отмывочного периода (7 дней). Препараты принимали, запивая водой. В каждом периоде у добровольцев проводился забор 22 образцов крови в количестве 5–6 мл в дискретные интервалы времени по следующей схеме: за 10–15 мин до приема препарата (00:00) и после приема препаратов через 15 мин (00:15), 30 (00:30), 40 (00:40), 50 мин (00:50), 1 ч (01:00), 1 ч 15 мин (01:15), 1 ч 30 мин (01:30), 1 ч 45 мин (01:45), 2 ч (02:00), 2 ч 20 мин (02:20), 2 ч 40 мин (02:40), 3 ч (03:00), 3 ч 30 мин (03:30), 4 (04:00), 5 (05:00), 6 (06:00), 8 (08:00), 10 (10:00), 12 (12:00), 16 (16:00) и 24 (24:00) ч.
Поскольку при назначении препарата режим приема пищи не регламентирован [12], а предыдущие исследования проводились натощак, представляло интерес изучение фармакокинетики в связи с приемом пищи. Проведено открытое нерандомизированное исследование, в ходе которого каждый доброволец (n=6) поэтапно получал 50 мг силденафила: 1) спрей под язык после приема пищи не запивая, 2) спрей в рот не вдыхая, после приема пищи запивая водой (200 мл) и 3) таблетку после приема пищи запивая. Исследование состояло из скрининга, трех этапов приема препаратов (каждый период наблюдения составил 24 ч) и двух отмывочных периодов (по 3 дня). На каждом из этапов исследования у добровольцев проводился забор 24 образцов крови по 4 мл: до приема препарата (в 00:00) и после приема препаратов через 5, 10, 15, 20, 30, 40, 50 мин, 1 ч, 1 ч 15 мин, 1 ч 30 мин, 1 ч 45 мин, 2 ч, 2 ч 20 мин, 2 ч 40 мин, 3 ч, 3 ч 30 мин, 4 ч, 5, 7, 9, 12, 16 и 24 фч. Исследования проводили с 5 по 25 октября 2017 г. и с 18 по 29 мая 2020 г. в ООО «Научно-исследовательский центр “Экобезопасность”».
Биоаналитическая методика. На каждом из этапов исследований у добровольцев проводился забор образцов крови в течение суток. Оценку биоэквивалентности проводили посредством высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием [10]. Методика валидирована в соответствии с требованиями Руководства по экспертизе лекарственных средств [11].
Фармакокинетические показатели. После однократного приема препаратов оценивали следующие параметры силденафила: 1) максимальную концентрацию (C max ), 2) площадь под фармакокинетической кривой «концентрация–время» начиная с нулевого значения времени до времени последнего забора крови (AUC 0-t). Дополнительными параметрами были: 1) AUC от нулевого значения времени до бесконечности (AUC 0-∞); 2) время достижения Cmax (T max) для силденафила и его активного метаболита N-десметилсилденафила.
Статистическая обработка данных. Анализ проведен с использованием статистического пакета R и Microsoft Office Excel, 2010. Применяли методы описательной статистики. Сравнение средних значений (Ср) фармакокинетических параметров проводили на основе мультипликативной модели. Статистическую значимость различий Тmax определяли с помощью двустороннего непараметрического T-критерия Вилкоксона. Биоэквивалентность оценивали путем расчета 90% доверительного интервала (ДИ) для отношения средних.
Этические аспекты. Исследования проведены в соответствии с международными стандартами надлежащей клинической практики (ICH GCP), надлежащей лабораторной практики (GLP), локальным законодательством и принципами, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации. Исследования одобрены Советом по этике при Министерстве здравоохранения (выписка из протокола No 143 от 14.03.2017) и Локальным этическим комитетом ООО «Научно-исследовательский центр “Экобезопасность”» (выписка No 4 из Протокола заседания No 20 от 24.08.2017 и выписка No 1 из Протокола заседания No 134 от 19.03.2020). Все участники подписывали информированное согласие до начала исследования.
Результаты. Исследование биоэквивалентности. Скринингу были подвергнуты 50 здоровых добровольцев-мужчин, из которых 44 вошли в исследование. Методом рандомизации добровольцы были распределены в две сопоставимые группы по 22 человека. В ходе исследования один участник отказался от участия по причинам, не связанным с исследованием. Средний возраст составил 25 (18–43) лет, индекс массы тела – 23 (19–29) кг/м². Графики зависимости «концентрация–время» сравниваемых препаратов оказались сопоставимыми, что указывает на их биоэквивалентность (рис. 1).
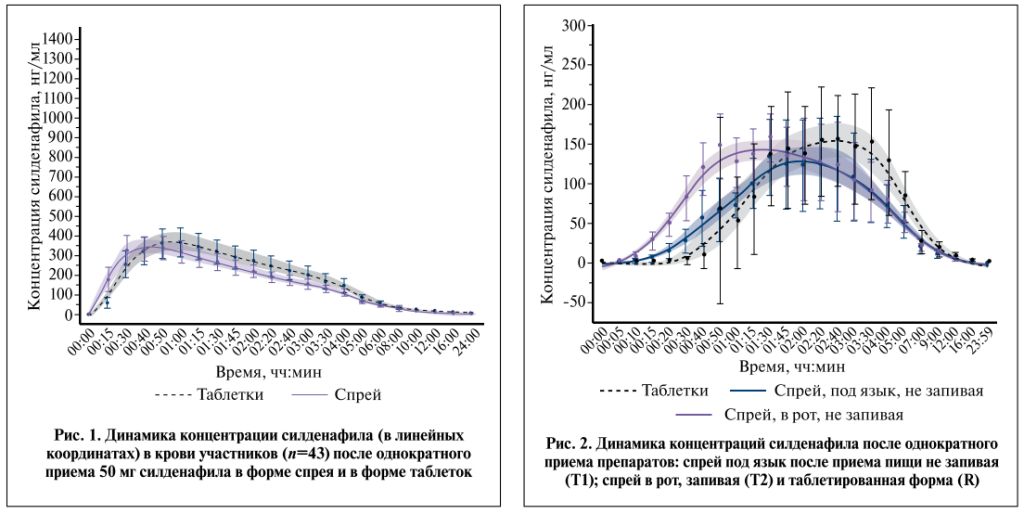
Как видно из табл. 1, после однократного приема спрея натощак раньше достигалась Cmax в среднем через 51 мин по сравнению с препаратом сравнения – в среднем 62 мин (Z-value=-2,3, p=0,02).
При сравнении основных фармакокинетических параметров между препаратами (T/R) выявлено, что 90% ДИ укладывались в допустимый диапазон (80–125%), указывая на биоэквивалентность препаратов. Для силденафила 90% ДИ отношения средних значений Cmax T/R составил 82–106%, для значений AUC0-t 90% ДИ равен 82–101%; для N-десметилсилденафила 90% ДИ для показателей Cmax и AUC 0-t составил 89–118 и 86–107 % соответственно. Время достижения ½ Cmax для силденафила-спрея составило 15±9 мин, для референтного препарата – 33±11 мин (p<0.05). Кроме того, выявлено, что отношение AUC 0-∞ /AUC 0-t, силденафила и N-десметилсилденафила превышало 0,8 для всех субъектов, что позволяет сделать вывод о достаточной длительности наблюдения за профилем «концентрация–время».
Исследование влияния приема пищи. Медиана возраста вошедших в исследование 6 здоровых добровольцев-мужчин составила 29 (23–35) лет, индекса массы тела – 26 (23–29) кг/м2. Визуальный анализ показал, что силденафил после приема спрея определялся через 10 мин, а после приема таблетированной формы – через 30 мин (рис. 2). Вероятно, при приеме таблетированной формы эффект наступает позднее, чем после спрея.
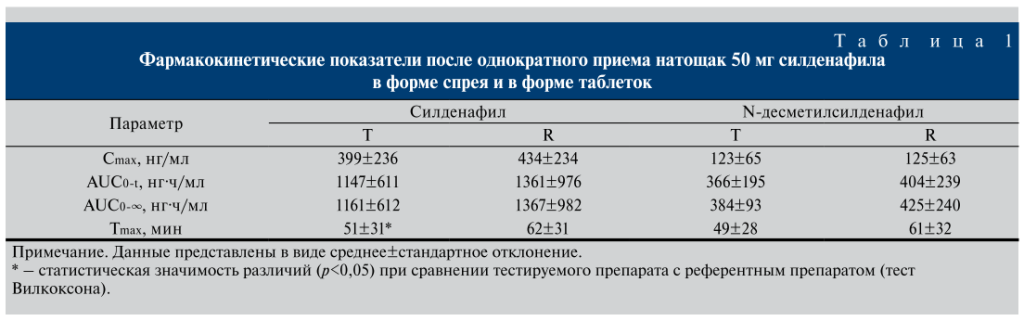
В табл. 2 представлены фармакокинетические параметры силденафила и N-десметилсилденафила в трех вариантах приема силденафила. Диапазон Tmax силденафила после приема спрея под язык после приема пищи не запивая (Т1) варьировался от 1 ч 30 мин до 2 ч 40 мин, для спрея в рот запивая (Т2) – от 50 мин до 2 ч 40 мин и для референтного препарата (R) – от 1 ч 30 мин до 3 ч 30 мин. Значимые различия выявлены между показателями Tmax N-десметилсилденафила после приема спрея не запивая (T1) и R (значение T-критерия Вилкоксона=1,9, p=0,06).
Обсуждение. Исследование двух лекарственных форм натощак показало отсутствие различий по основным фармакокинетическим параметрам, 90% ДИ для силденафила находились в диапазоне от 80 до 125%, что соответствует требованиям исследований биоэквивалентности [7]. Спрей характеризуется более ранним достижением Cmax по сравнению с таблетированной формой препарата, что может иметь большую клиническую ценность.
Результаты второго исследования показали, что при приеме спрея силденафила после еды Cmax силденафила достигается быстрее, чем после приема таблетки. Несмотря на отсутствие статистической значимости различий по показателю Tmax между препаратами, более раннее определение в крови метаболита и более короткий Tmax могут обеспечивать более раннее начало терапевтического эффекта. Это важный фактор, обеспечивающий более удобный для пациента прием и большую удовлетворенность.
Заключение. Таким образом, на рынке доступна альтернативная пероральная лекарственная форма препарата, которая обладает преимуществами по сравнению с обычными таблетками: 1) быстрое действие как натощак, так и после приема пищи, 2) удобное применение для пациентов, которые испытывают трудности при проглатывании таблеток. Исследования проводились на ограниченном количестве здоровых, молодых добровольцев, которые могут представлять группу быстрых метаболизаторов. Дальнейшие исследования могут быть направлены на изучение фармакокинетики и эффективности на выборке пациентов с эректильной дисфункцией. Удовлетворенность от приема препаратов является индивидуальной характеристикой [12], следовательно, в будущих исследованиях необходимо учитывать личные предпочтения пациентов и ожидания от приема препарата.
Литература
1. Hatzimouratidis K., Hatzichristou D.G. A Comparative Review of the Options for Treatment of Erectile Dysfunction .hich Treatment for Which Patient ? Drugs. 2005;65(12):1621–1650. doi:https://doi.org/10.2165/00003495-200565120-00003
2. Akhvlediani N.D., Matyukhov I.P. Current role of sildenafil in the management of erectile dysfunction. Urologiia. 2018;2:142–146. https://doi.org/10.18565/urology.2018.2.142–146. Russian (Ахвледиани Н.Д., Матюхов И.П. Современное место силденафила в лечении эректильной дисфункции. Урология. 2018;2:142–146. https://doi.org/10.18565/urology.2018.2.142–146)
3. Goldstein I., Lue T.F., Padma-Nathan H., Rosen R.C., Steers W.D., Wicker P.А. Oral sildenafil in the treatment of erectile dysfunction. N Engl J Med. 1998;338(20):1397–1404.
5. Laupland K.B., Helmersen D., Zygun D.A., Viner S.M., Laupland K.B., Helmersen D., Zygun D.A., Sildenafil S.M.V. Sildenafil treatment of primary pulmonary hypertension. Can Respir. 2003;10(1):48–51. doi:https://doi.org/10.1155/2003/612905
6. Debruyne F.M.J., Gittelman M., Sperling H., Beneke M. Time to onset of action of vardenafil: A retrospective analysis of the pivotal trials for the orodispersible and film coated tablet formulations. J Sex Med. 2011;8(10):2912–2923. doi:10.1111/j.1743-6109.2011.02462.x
7. Guidelines for the examination of medicines. Volume I. Moscow: Vulture and K, 2013. Russian (Руководство по экспертизе лекарственных средств. Том I. Москва: Гриф и К, 2013).
8. Kanjanawart S., Gaysonsiri D., Tangsucharit P., Vannaprasaht S,, Phunikhom K,, Kaewkamson T,, Wattanachai N,, Tassaneeyakul W. Comparative bioavailability of two sildenafil tablet formulations after single-dose administration in healthy Thai male volunteers. Int J Clin Pharmacol Ther. 2011;49(8):525. Doi: 10.5414/cp201496.
9. Spinola A.C.F., Almeida S., Filipe A., Tanguay M., Yritia M. Bio equivalence study of two tablet formulations of sildenafil. Arzneimittelforschung. 2008;58(3):122–25. Doi: 10.1055/s-0031-1296480.
10. Challa B.R., Awen B.Z., Chandu R., Khagga M. Sildenafil and N-desmethyl sildenafil quantification in human plasma by HPLC coupled with ESI-MS / MS detection: Application to bioequivalence study. Anal Methods. 2010;2(8):1043–1050. Doi: 10.1039/c0ay00062k.
11. Rodionov G.G., Shantyr I.I., Ushal I.Je., Svetkina E.V., Kolobova E.A. ZKA. HPLC-MS/MS method for quantitation of sildenafil and its active metabolite in human plasma. The Bulletin of the Scientific Centre for Expert Evaluation of Medicinal Products. 2020;10(3):192–200. doi:https://doi.org/10.30895/1991-2919-2020-10-3-192-200. Russian (Родионов Г.Г., Шантырь И.И., Ушал И.Э., Светкина Е.В., Колобова Е.А., Захаров К.А. ВЭЖХ-МС/МС методика количественного определения силденафила и его метаболита в плазме крови человека. Ведомости Научного центра экспертизы средств медицинского применения. 2020; 10(3):192-200. https://doi.org/10.30895/1991-2919-2020-10-3-192-200)
12. Smith W.B., McCaslin I.R., Gokce A., Mandava S.H., Trost L., Hellstrom W.J. PDE5 inhibitors : considerations for preference and long-term adherence. Int J Clin Pract. 2013;67(8):768–780. doi:10.1111/ijcp.12074


